Felfedező kutatástól a szabadalomig
Mi volt a kutatás célja, és mikortól vált közössé a munka?
Gereben Balázs (Molekuláris Sejt Metabolizmus Csoport): Az idegrendszeri pajzsmirigyhormon-háztartás különböző aspektusait tanulmányoztuk neurobiológiai módszerekkel kombinált sejt- és molekuláris biológiai megközelítésekkel. E vizsgálatok hátterének megértéséhez fontos tudni, hogy a pajzsmirigyhormonok (PMH) komoly befolyást gyakorolnak szinte minden sejtünk és szervrendszerünk működésére. E hatás jelentős mértékben a sejtek anyagcseréjének és ezáltal az energiaháztartás szabályozásának, illetve a sejtosztódásnak és a sejtek differenciálódásának a szabályozásán keresztül valósul meg.
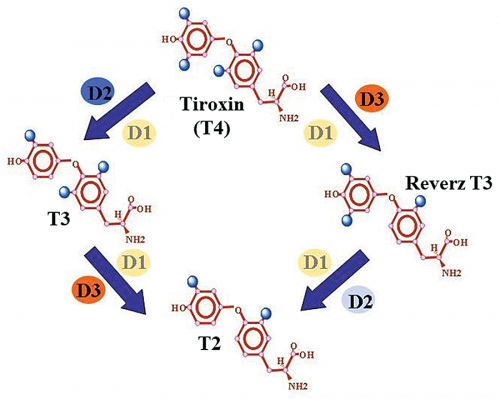 Pajzsmirigyhormonok és metabolizmusuk. Az emberi pajzsmirigy fő terméke a T4 elő- hormon, amelyet a kettes típusú dejodáz (D2) enzim egy jód lehasításával T3-má aktivál. Inaktiváló útvonal is létezik, ennek során a T3-at T2-vé, a T4-et rT3-má alakítja a hármas típusú dejodáz (D3) enzim. Az rT3 lebontását az egyes típusú dejodáz (D1) végzi. (Gereben és mtsai. Endocr Reviews 2008 alapján.)
Pajzsmirigyhormonok és metabolizmusuk. Az emberi pajzsmirigy fő terméke a T4 elő- hormon, amelyet a kettes típusú dejodáz (D2) enzim egy jód lehasításával T3-má aktivál. Inaktiváló útvonal is létezik, ennek során a T3-at T2-vé, a T4-et rT3-má alakítja a hármas típusú dejodáz (D3) enzim. Az rT3 lebontását az egyes típusú dejodáz (D1) végzi. (Gereben és mtsai. Endocr Reviews 2008 alapján.)Összességében tehát a PMH-k nagyon markáns módon képesek hatást gyakorolni a legkülönbözőbb sejttípusokra. A hipotalamusz-hipofízis-pajzsmirigy (HHP) tengely szabályozza, hogy ezeknek a hormonoknak a vérben milyen szintje alakul ki. Ez egy nagyon jól szabályozott, robusztus rendszer, amely a vér PMH-szintjét jellemzően stabilan tartja. Ennek alapján az a kérdés, hogy mi biztosítja, hogy a PMH-k különböző sejttípusokra testre szabott és időben is jól szabályozott hatást fejtsenek ki. Az elmúlt évtizedekben jelentős ismeretek halmozódtak fel a szakterületen a szöveti PMH-hatás szabályozásával kapcsolatban. Világossá vált, hogy létezik egy olyan összetett szabályozórendszer, amely lehetővé teszi, hogy a PMH lokális szintje szövet- és sejtspecifikusan, térben és időben jól behatároltan, megfelelően szabályozott legyen. A pajzsmirigyből a keringésbe kerülő PMH legnagyobb része inaktív hormon, amelyet a dejodáz enzimrendszer tagjai alakítanak át aktív, a PMH-receptorhoz kötődni képes hormonná, és a PMH inaktiválását is dejodáz enzimek végzik. Ezek az enzimek hatnak a vér PMH-szintjére is, de jelentősen befolyásolják a szövetekben a PMH-koncentrációt is. Így a vér viszonylag állandó PMH-szintje ellenére a dejodáz enzimek bizonyos sejtekben és szövetekben nagyon gyors, lokális szabályozást képesek biztosítani. Ez különösen fontos az agyban, ahol például az agykéregben még a keringő PMH-szintek jelentős változása esetén is stabil a lokális PMH-háztartás.
A mi munkacsoportunk régóta foglalkozik a dejodáz enzimrendszer molekuláris szabályozásával, korábban részt vettünk ezen enzimek genetikai kódjának meghatározásában is. Ez megnyitotta az utat az előtt, hogy rekombináns DNS-technológián alapuló technikákkal mesterségesen is elő tudjuk állítani ezeket a fehérjéket, és olyan módon tanulmányozzuk őket, ami klasszikus biokémiai módszerekkel nem lenne lehetséges.
A NAP által támogatott vizsgálatainkban ezekre az eredményeinkre alapozva tanulmányoztuk az agyi PMH-háztartás sejttípus-specifikus szabályozását és annak egyes biológiai jelenségekre gyakorolt hatását. Vizsgáltuk, hogy a PMH-k milyen befolyást gyakorolnak a felnőtt idegrendszer egyes régióiban folyó idegsejtképződésre. Világossá vált, hogy e hormonoknak és lokális szabályozásuknak szerepük van az idegi progenitor sejtek átalakulásában. Ezzel párhuzamosan igyekeztünk jobban megérteni, hogy az idegsejteken belül hogyan történik a PMH-k vándorlása. Ehhez a munkához szükség volt egy olyan genetikailag módosított, transzgenikus egérmodell előállítására, amely lehetővé teszi a PMH-jelátvitel mérését egyes agyrégiókban, valamint más, agyon kívüli szövetekben is. Ez egy fontos kapcsolódási pont volt a Fekete Csaba munkacsoportja által végzett vizsgálatokhoz.
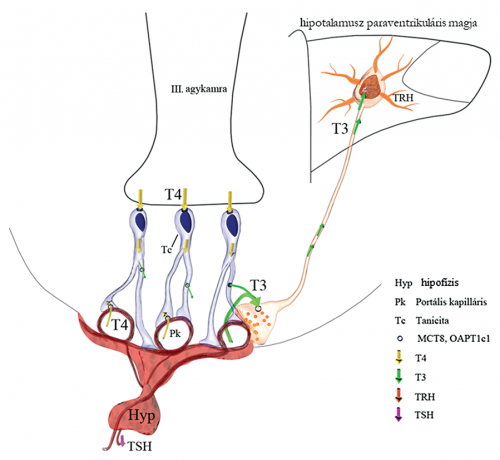 A hipotalamusz-hipofízis-pajzsmirigy tengely szerveződése. Az agy hipotalamusz nevű régiójában található paraventrikuláris idegmag TRH-termelő idegsejtjeinek axonjaiból felszabaduló TRH növeli a hipofízis TSH termelését, ami serkenti a pajzsmirigyműködést. A III. agykamra falában ülő tanicita sejtek kettes típusú dejodáz (D2) enzimje által termelt T3 is részt vesz a TRH-termelés csökkentésében a „feedback” szabályozás során. (Fekete és mtsai. Endocr Reviews 2014 alapján.)
A hipotalamusz-hipofízis-pajzsmirigy tengely szerveződése. Az agy hipotalamusz nevű régiójában található paraventrikuláris idegmag TRH-termelő idegsejtjeinek axonjaiból felszabaduló TRH növeli a hipofízis TSH termelését, ami serkenti a pajzsmirigyműködést. A III. agykamra falában ülő tanicita sejtek kettes típusú dejodáz (D2) enzimje által termelt T3 is részt vesz a TRH-termelés csökkentésében a „feedback” szabályozás során. (Fekete és mtsai. Endocr Reviews 2014 alapján.)Neuronális plaszticitás és az energiaháztartás kapcsolata volt a pályázata témája. Miről szólt a NAP keretében folytatott kutatás?
Fekete Csaba (Integratív Neuroendokrinológia Csoport): Régebben úgy tartották, hogy a fejlődés során kialakult idegrendszeri hálózat az életünk végéig ugyanolyan formában megmarad. Az elmúlt évtizedekben viszont kiderült, hogy ez nem egészen így van. Új kapcsolatok alakulnak ki az idegsejtek között, illetve bizonyos retrográd jelátvivő anyagok segítségével az idegsejtek képesek szabályozni az őket beidegző axon végződések aktivitását. A NAP pályázat keretében azt vizsgáltuk, hogy az ilyen plasztikus változások szerepet játszanak-e az energiaháztartás szabályozásában. Többféle szempontból közelítettük meg a kérdést. Az egyik kutatásunk annak feltárására irányult, hogy két, az energiaháztartás szempontjából kritikus sejtcsoport, az arcuatus mag és a paraventrikuláris mag közötti kapcsolat strukturálisan változik-e. Megfigyeltük, hogy a paraventrikuláris mag idegsejtjei az arcuatus magból éhezés hatására kevesebb serkentő és több gátló beidegzést kapnak, és ez a változás csak 24 óra újratáplálás után szűnik meg. Ez a strukturális változás magyarázhatja, hogy a paraventrikuláris magban elhelyezkedő TRH-termelő idegsejtek, melyek a PMH termelődését szabályozzák, miért nem aktiválódnak rögtön az éhezést követő újratáplálás hatására.
Az arcuatus mag sejtjeinek egyik ingerületátvivő anyaga a neuropeptid Y (NPY), amely jelentősen fokozza a paraventrikuláris magba jutva a táplálékfelvételt, és csökkenti az energialeadást, ezáltal elhízást képes okozni. Vizsgáltuk, hogy az NPY milyen mechanizmusokon keresztül hozza létre e hatásait a paraventrikuláris magban.
In vitro elektrofiziológia alkalmazásával kimutattuk, hogy az NPY hatására a paraventrikuláris mag idegsejtjei retrográd jelátvivő anyagokat bocsátanak ki, és ezzel meggátolják, hogy a táplálkozástól független idegi kapcsolatok is képesek legyenek befolyásolni a paraventrikuláris mag idegsejtjeit. Ez egy nagyon gyors szabályozás, amihez nincs szükség strukturális változásra, szinte azonnal képes ez a mechanizmus megakadályozni, hogy idegi kapcsolatok felülírják az NPY-nak a paraventrikuláris mag sejtjeire kifejtett hatását. In vivo vizsgálatokkal feltártuk, hogy ezeknek az NPY hatására felszabaduló jelátvivő anyagoknak pontosan mi a szerepük az energialeadás, a táplálékfelvétel, valamint a mozgás szabályozásában.
Miért választotta ezt a kutatási témát, mit tartott benne izgalmasnak, és mióta foglalkozik vele?
F. CS.: Közel két évtizede foglalkozom a hipofiziotróp tirotropin-releasing hormont (TRH) termelő idegsejtek szabályozásával. E sejtek irányítják a pajzsmirigy működé-sét, kritikus szerepük van a vér PMH-szintjének szabályozásában. Munkacsoportunk egyik fő célja, hogy megértsük ezeknek a sejteknek a működését egyrészt azért, hogy a pajzsmirigy agyi szabályozását feltárjuk, másrészt, mert e sejtek a pajzsmirigyműködés befolyásolásán keresztül nagyon fontos szerepet játszanak az energiaháztartás szabályozásában. Ha több PMH-nk van, akkor sokkal több energiát ad le a szervezetünk. Ha valakinek alacsony a PMH-szintje, akkor pedig jelentősen csökkent az energialeadása. Természetesen ez a PMH csak az egyik, de nagyon fontos hatása. A NAP pályázat keretében az arcuatus mag és a paraventrikuláris mag közti kapcsolat plaszticitására irányuló vizsgálataink segítettek jobban megérteni a hipofiziotróp TRH idegsejtek szabályozásának mechanizmusát is.
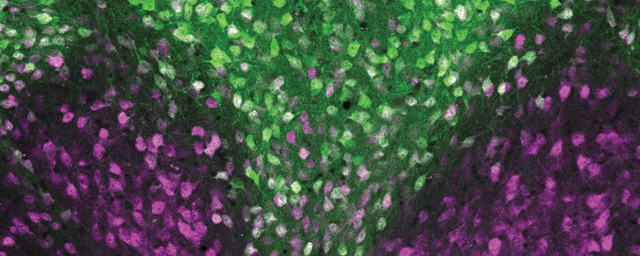
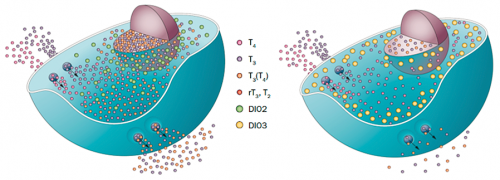 A pajzsmirigyhormon (PMH) háztartás szabályozása sejttípus-specifikus. A sejtekben egy összetett, szigorúan szabályozott rendszer felügyeli az adott sejtnek adott időintervallumban szükséges PMH-szint beállítását. A kettes típusú dejodáz (D2) enzimet termelő sejtek (pl. agyi glia sejtek, baloldalt) maguk aktiválják a számukra szükséges PMH-mennyiséget, míg más sejtek (pl. az idegsejtek, jobb-oldalt) a T3-at importálják, és annak szintjét D3 enzim általi bontással állítják be. (Gereben és mtsai. Nature Rev Endo 2015.)
A pajzsmirigyhormon (PMH) háztartás szabályozása sejttípus-specifikus. A sejtekben egy összetett, szigorúan szabályozott rendszer felügyeli az adott sejtnek adott időintervallumban szükséges PMH-szint beállítását. A kettes típusú dejodáz (D2) enzimet termelő sejtek (pl. agyi glia sejtek, baloldalt) maguk aktiválják a számukra szükséges PMH-mennyiséget, míg más sejtek (pl. az idegsejtek, jobb-oldalt) a T3-at importálják, és annak szintjét D3 enzim általi bontással állítják be. (Gereben és mtsai. Nature Rev Endo 2015.)Habár Gereben Balázs munkacsoportjának és a mi munkacsoportunknak jelentősen különböző a módszertani háttere, mindkét munkacsoport számára elengedhetetlenné vált, hogy vizsgálni tudjuk: bizonyos hatásokra miként változik a szövetekben lokálisan a PMH-hatás. Ennek érdekében hoztunk létre közösen egy olyan emlős állatmodellt, amely lehetővé teszi a PMH-jelátvitel mérését. A többi között itt kapcsolódik a két kutatócsoport munkája egymáshoz.
Melyek a létrehozott egérmodell fő jellemzői?
G. B.: A pajzsmirigyhormon-hatás mérésére szolgáló transzgenikus indikátor egér (Thyroid Hormone Action Indicator [THAI] Mouse) a két munkacsoport közös erőfeszítéseinek eredményeként jött létre. Mohácsik Petra PhD-hallgatóként nagyban hozzájárult a munka sikeréhez, a biotechnológiai megoldásokban pedig az Intézet Orvosi Géntechnológiai Részlegének munkatársai, Erdélyi Ferenc és Szabó Gábor nyújtottak fontos segítséget. Ez az első olyan emlős állatmodell, amelyben a PMH-jelátvitel mérése élő állatokban is megvalósítható. Egy olyan mesterséges rekombináns DNS-konstrukciót építettünk az egér genomjába, amelyben egy jól mérhető aktivitású, úgynevezett riporter fehérje szintjét a PMH-k specifikusan szabályozni képesek. Riporter fehérjeként a szentjánosbogár fényét létrehozó luciferáz fehérjét használtuk. Ez a fehérje a szubsztrátja jelenlétében fényt állít elő, ami élő állatban is mérhető, és a riporter fehérje szintje más közvetlen módszerekkel is meghatározható. A THAI egérmodell lehetővé teszi, hogy akár nagyon kicsi agyterületek esetében is meghatározzuk, hogy a szöveti PMH-hatást befolyásoló folyamatok eredményeként hogyan változik a vizsgált szövetben a PMH-hatás. Azaz a vizsgált szövetben történt változások miként befolyásolják a PMH-nak a PMH-érzékeny gének aktivitására kifejtett hatását. Korábban nem létezett olyan módszer, amellyel ezt a kérdést vizsgálni lehetett volna, mert az állatok génjeit a PMH mellett számos más hatás is befolyásolja, így nem lehetett eldönteni, hogy egyes gének aktivitásváltozása valóban a PMH-hatás következménye-e.
A modellt sokrétűen jellemeztük molekuláris és metabolikus módszerekkel, és ezek alapján az állatok teljesen egészségesek, élettani folyamataikat nem befolyásolja a genetikai módosítás.
 A pajzsmirigyhormon-hatás mérésére szolgáló transzgenikus indikátor (THAI) egér a pajzsmirigyhormon jelátvitel mérését teszi lehetővé. A luciferáz riporter fehérje a pajzsmirigyhormon jelátvitel szintjével arányos fényt bocsát ki, ami élő állatban is mérhető.
A pajzsmirigyhormon-hatás mérésére szolgáló transzgenikus indikátor (THAI) egér a pajzsmirigyhormon jelátvitel mérését teszi lehetővé. A luciferáz riporter fehérje a pajzsmirigyhormon jelátvitel szintjével arányos fényt bocsát ki, ami élő állatban is mérhető.Úgy tudom, hogy a THAI transzgenikus állatmodellt szabadalmaztatják.
G. B.: Az állatmodellnek mind a magyar, mind a nemzetközi szabadalmaztatása folyamatban van. De már rendelkezünk az Európai Szabadalmi Hivatal pozitív, úgynevezett PCT elővéleményével, ami nagyon bizakodóvá tesz minket, mivel elismeri a szabadalmi bejelentés újdonságát, feltalálói jellegét és ipari hasznosíthatóságát. A közeljövőben várható az európai uniós szabadalmi jogi döntés. Ezzel párhuzamosan az Egyesült Államokban is folyik a szabadalmaztatási eljárás.
F. CS.: Korábban nem létezett olyan módszer, amellyel vizsgálni tudtuk volna egy-egy szövetben a pajzsmirigyhormon jelátvitel mértékét. Meg tudtuk mérni a vérben lévő pajzsmirigyhormonszintet, azt viszont már nem, hogy az egyes vizsgálandó sejtcsoportokban milyen PMH-hatás alakul ki.
A THAI-modellel egy-egy kisebb agyterületen, illetve a perifériás szövetekben is vizsgálni tudjuk a PMH magreceptorán kifejtett hatásait. Ráadásul a riporter fehérje által mért változások teljesen intakt, az állatban természetesen meglévő, a PMH jelátvitel szabályozásában részt vevő fehérjék jelenlétében jön létre. Mi azt tettük lehetővé, hogy a PMH-receptorok egy specifikus genetikai elemen keresztül meg tudják változtatni a riporter fehérje mennyiségét a sejtekben.
A NAP támogatásával milyen közös új eredmények születtek, például a THAI állatmodell nyújtotta tesztelési lehetőségek kihasználásával?
F. CS.: Maga az állatmodell létrehozása és jellemzése mellett konkrét alaptudományi vizsgálatokat is végeztünk, mivel éppen ezért hoztuk létre ezt az egérmodellt. Például tanulmányoztuk az alacsony T3 szindróma, egy gyakori endokrin kórkép kialakulásának mechanizmusát. Ez egy olyan állapot, amikor a betegek pajzsmirigyműködése teljesen ép, azonban jellemzően súlyos betegség hatására, operáción átesett, daganatos betegekben, infarktust vagy nagy felületű égést követően, gátlódik a hipotalamusz-hipofízis-pajzsmirigy tengely működése, a keringésben lecsökken a PMH és a TSH szintje.
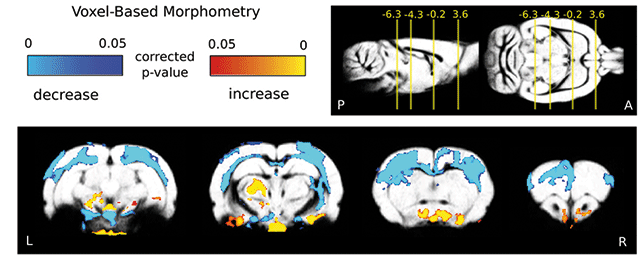
G. B.: Az intenzív osztályon fekvő betegek szinte mindegyikénél megfigyelhető ez az állapot. Ez a régóta ismert, de tisztázatlan hátterű szindróma egérben is előidézhető, tüneteit THAI egérben kiváltva, vizsgálatainkkal közvetlenül bizonyítottuk egy olyan mechanizmus létezését, amely a szindróma kialakulása során a hipotalamusz-hipofízis-pajzsmirigy tengely gátlásához vezet. Ehhez arra volt szükség, hogy a THAI-modellben alacsony T3 szindróma kiváltása után meg tudjuk mérni a PMH-jelátvitelt a hipotalamusz specifikus, körülhatárolt alrégióiban.
F. CS.: Arra voltunk kíváncsiak, hogy amikor a perifériás vérben alacsony a PMH-szint, hogyan alakul a hormon hatása a hipotalamusz-hipofízis-pajzsmirigy tengely szabályozásában fontos szerepet játszó agyterületeken. Azt tapasztaltuk, hogy a hipotalamuszban − ami a HHP-tengely szabályozásában kritikus szerepet játszik – az alacsony T3 szindróma állatmodelljében megemelkedett a PMH-hatás. Ezt a PMH-aktiváló enzim szintjének az emelkedése okozza, és valószínűleg pont ez a lokális hatás hozza létre a pajzsmirigyműködés gátlását, mert a már említett TRH-sejtek úgy érzékelik, hogy a szervezetben túl sok aktív pajzsmirigyhormon van. Ennek az az oka, hogy lokálisan, ahol ezek a sejtek találhatók, valóban megnőtt a pajzsmirigyhormonok szintje az aktiváló enzim hatására. Érdekes módon, míg az agy körülhatárolt területein az állatmodellben hipertiroidizmus, azaz megemelkedett PMH-hatás alakul ki, addig ugyanabban az állatban a periférián vannak olyan szövetek, ahol lokális hipotiroidizmus, azaz alacsony pajzsmirigyhormonszint alakul ki, és van olyan szövet, ahol viszont a PMH-hatás nem változik annak ellenére, hogy a vérben csökken a PMH szintje. Feltételezzük, hogy a betegség hatására tapasztalható PMH-szintcsökkenés egy alkalmazkodási mechanizmus, amely, legalábbis a betegség első szakaszában, segít spórolni az energiát, és ezáltal segíti a felépülést.
G. B.: Egy másik, a THAI egérmodell alkalmazásával elért eredményünk a hőtermelésben kritikus szerepet játszó barna zsírszövet (BAT) működésének szabályozásával kapcsolatos. Egy olyan speciális zsírszövetről van szó, amely nem elraktározza az energiát, hanem a zsírsavak égetésével hőtermelést végez. Mivel modern képalkotó technikák alkalmazásával kimutatták, hogy felnőtt emberekben is megtalálható a BAT, e zsírszövet szabályozó mechanizmusainak megértése fontos lehet az elhízás elleni küzdelemben. A BAT működésének szabályozásában lényeges szerepet játszik a szimpatikus idegrendszer. A BAT hőtermeléséről ismert volt, hogy a PMH és a szimpatikus idegrendszer együttesen, kölcsönhatásban szabályozzák. Az állatmodellünknek köszönhetően élő emlősben is mérhetővé vált a barna zsírszövet PMH jelátvitelének változása, ki tudtuk mérni, hogy egyes eltérő kísérleti körülmények között másként befolyásolja a szimpatikus idegrendszer a PMH BAT-ban kifejtett hatását, ami a szövet hőtermelő képességének fontos szabályozó tényezője.
Milyen kísérletekhez lehet majd használni a jövőben az új transzgenikus egérmodellt?
F. CS.: Az állatmodellt a saját kutatásainkhoz hoztuk létre, de közben kiderült, hogy alkalmas lehet gyógyszeripari vizsgálatokhoz is. Ezért zajlik most a szabadalmaztatási eljárás. A PMH ugyanis például az egyik legjobb koleszterinszint-csökkentő anyag, és testsúlycsökkentő hatása is van, ami ideálissá tenné a metabolikus szindróma kezelésére. Azonban a PMH-nak számos nemkívánatos, elsősorban szívre és agyra gyakorolt hatása miatt PMH gyógyszerként nem adható olyan embereknek, akiknek a pajzsmirigyműködése normális. Ezért a gyógyszerfejlesztők mellékhatások nélküli, módosított PMH-analógokat szeretnének előállítani, ahol a PMH kedvező metabolikus hatásai mellékhatás-mentesen válthatók ki. Számukra értékes lehet a THAI-modell, mert lehetőséget ad e gyógyszerjelölt gyors és költséghatékony tesztelésére élő állatokban.
Folytatják tovább a NAP 2-ben a közös munkát?
F. CS.: Igen, nagy örömünkre lehetőséget kaptunk a folytatásra, a NAP 2 program keretében egy közösen benyújtott pályázatunk támogatást nyert. Emellett a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal is támogatta a Gereben Balázs témavezetésével beadott közös pályázatunkat, melyhez szintén nélkülözhetetlen a THAI-modell használata.
G. B.: A THAI egérmodell emellett lehetővé tette, hogy csoportjaink csatlakozzanak egy EU H2020 keretprogramban pályázó konzorciumhoz. E konzorcium pályázatában az agyi és perifériás PMH-háztartás öregedés során bekövetkező változásainak jobb megértését tűzte ki célul, és az elmúlt évben jelentős összegű támogatást nyert.•
2017. december