Feltárták egy fehérje térszerkezetét
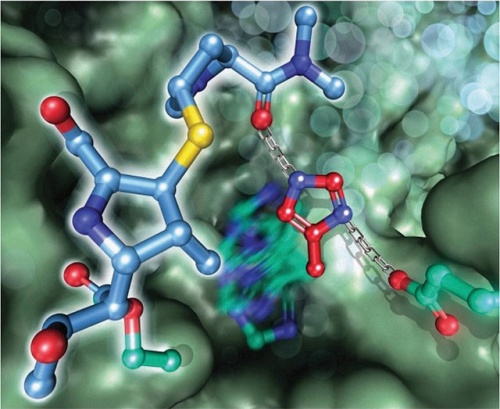 A Royal Society of Chemistry folyóirat címlapján az ELTE kutatói által feltérképezett emlős AAP fehérje meropenem antibiotikummal gátolt szerkezete látható.
A Royal Society of Chemistry folyóirat címlapján az ELTE kutatói által feltérképezett emlős AAP fehérje meropenem antibiotikummal gátolt szerkezete látható.Az ember genetikai kódjának ismeretében a tudomány ma már meglehetősen pontos képet alkotott arról, hogy milyen fehérjék fordulnak elő szervezetünkben. A DNS-ben található információ azonban csak a fehérje építőkockáinak, az aminosavaknak a sorrendjét adja meg. Ahhoz, hogy megtudjuk, mire képes egy adott fehérje a valóságban – milyen molekulákkal lép kapcsolatba, milyen reakciókban vesz részt –, ki kell deríteni azt is, hogy ez a jellemzően több száz elemből álló aminosavlánc milyen térbeli alakzatot vesz fel.
Perczel András akadémikus és kutatótársai az ELKH–ELTE Fehérjemodellező Kutatócsoportban és az ELTE Szerkezeti Kémiai és Biológiai Laboratóriumban sejtjeink egyik fontos „minőségbiztosítójának” a szerkezetét próbálták felderíteni. Az AAP (acilaminoacil-peptidáz) nevű enzim szerkezetének és működésének ismerete közvetlen segítséget jelenthet számos betegnek.
Az enzim térszerkezetének meghatározását megnehezítette egy, a kutatók számára igencsak kellemetlen tulajdonsága: nem lehet jól kristályosítani. Ekkor jött segítségül a krio-eletronmikroszkópia: ennél a fehérjemolekulák vizes oldatának egyetlen cseppjét fagyasztják le hirtelen és tartják igen alacsony hőmérsékleten, majd ezt az üvegszerűen átlátszó mintát világítják át fókuszált elektronnyalábokkal. Bonyolult számítási eljárással határozták meg a fehérje térbeli modelljét.•



























