Új Alzheimer- és Parkinson-kór gyógyászati stratégiák fejlesztése
A csoport jelenlegi tagjai: dr. Tóth Gergely, dr. Kiss Róbert, Solti Katalin, Mikes Anna és Holló Fanni; a csoport tagjai voltak: dr. Czajlik András, dr. Keresztes Attila, dr. Ioja Enikő, dr. Kárpáti Manuéla és Tóth Lilla; a csoport vendégkutatói: Fórizs Balázs, dr. Herberth Balázs és Kustos Gergely.
A csoport kutatási célja, hogy tanulmányozza és megmagyarázza bizonyos fehérjék hibás feltekeredésének (misfoldingjának) és aggregációjának mechanizmusát és okait, melyek szerepet játszanak az Alzheimer-kór (AK) és a Parkinson-kór (PK) kialakulásában, és ezek megelőzésére gyógyászati stratégiákat és gyógyszerjelölt vegyületeket fejlesszenek ki. A csoport multidiszciplináris kutatási megközelítést alkalmaz, egyebek között szerkezetalapú számítógépes tervezést, biofizikai, szerkezetbiológiai és biokémiai módszereket, valamint sejt- és állatmodelleket is felhasznál.
Az AK és PK kialakulása és terjedése szorosan kapcsolódik bizonyos rendezetlen fehérjék, mint az Aß, a tau és az α-szinuklein aggregációjához, melynek következtében e rendezetlen fehérjék amyloid fibrillek formájában halmozódnak fel a betegek agyában. Az egyik lehetséges racionális kutatási stratégia egy olyan terápia kifejlesztése, melynek során gyógyszerszerű vegyületek, illetve specifikus dajkafehérjék (chaperonok) alkalmazásával visszaszorítjuk e rendezetlen fehérjék aggregációját.
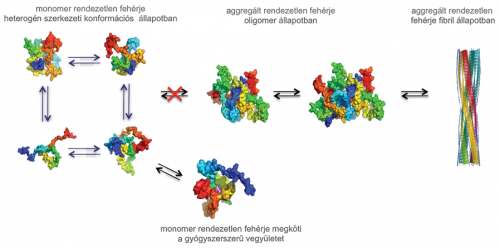 A gyógyszerszerű vegyület kötődik a monomer állapotú rendezetlen fehérjéhez, és ezáltal a fehérje eredeti szerkezetének stabilizálásával csökkenti a hibás (misfolded) szerkezet kialakulását és aggregációját.
A gyógyszerszerű vegyület kötődik a monomer állapotú rendezetlen fehérjéhez, és ezáltal a fehérje eredeti szerkezetének stabilizálásával csökkenti a hibás (misfolded) szerkezet kialakulását és aggregációját.A csoport kifejezetten a tau, az Aß42 és az α-szinuklein fehérjéket tanulmányozza, melyek misfoldolnak és aggregálódnak, ezáltal elvesztik az eredeti funkciójukat, és toxikussá válnak az agysejtek számára AK-ban és PK-ban. Ezek a fehérjék eredendően rendezetlen fehérjék, melyeknek nincs stabil harmadlagos szerkezetük, és dinamikus, heterogén szerkezeti konformációk összességeként léteznek. E rendezetlen fehérjék aggregációjának csökkentésére egy lehetséges megközelítés az aggregáció korai fázisban történő gátlása. Erre a célra alkalmasak lehetnek olyan kismolekulák, melyek kötődnek a monomer állapotú fehérjékhez, és azok eredeti szerkezetének stabilizálásával csökkentik a hibás (misfolded) szerkezet kialakulását és aggregációjukat, ezáltal elősegítve a fehérjék normális működését. Ezzel késleltetik vagy megállítják az aggregáció kezdeti lépéseit, ami a toxikus fehérje aggregátumok megszűnéséhez vezet. Egy ilyen terápiás megközelítés képes lehet lassítani a betegség kialakulását és előrehaladását. Azonban a rendezetlen fehérjék szerkezeti heterogenitása miatt ez a stratégia komoly kihívást jelent, mert még nem bizonyított egyértelműen, hogy a gyógyszerjelölt vegyületek a rendezetlen fehérjék monomer állapotához képesek erősen kötődni.
Tóth Gergely, majd később a csoport – együttműködve a Cambridge-i Egyetem (Egyesült Királyság), a Max Planck Intézet (Németország), valamint egy egykori gyógyszerkutató cég, az Elan Pharmaceuticals (Egyesült Államok) kutatóival – elméleti, szerkezetbiológiai modellezés alkalmazásával megmutatta, hogy léteznek gyógyszerszerű vegyületek megkötésére alkalmas kötőhelyek a tau, az Aß42 és az α-szinuklein fehérjék heterogén szerkezeti konformációinak összességén. A gyógyszerszerű vegyületek kötődése ezekhez a kötőhelyekhez a rendezetlen fehérjék szerkezeti konformációs állapotának a megváltozásához vezethet, továbbá hatással lehet a különböző szerkezeti konformációs állapotok dinamikus és termodinamikai egyensúlyára. Ezeket az eredményeket a többi között a következő tudományos folyóiratokban publikálták: PLoS One (9(2):e87133, 2015; és a Journal of Chemical Physics (139(3):035101 2013.
Ezek az eredmények azt mutatják, hogy kifejleszthető egy olyan gyakorlati stratégia, mely célba veszi a gyógyszerszerű vegyületek kötődésére alkalmas helyeket, és az ilyen potenciálisan kötődő vegyületeknek jelentős hatásuk lehet a rendezetlen fehérjék aggregációjának gátlásában. A koncepció igazolására Tóth Gergely és együttműködő partnerei kifejlesztettek egy újszerű gyógyszerkutatási megközelítést, mellyel olyan gyógyszerszerű vegyületeket azonosítottak, melyek a tau monomer állapotához kötődtek, és csökkentették a tau aggregációját in vitro és az AK sejtes modelljeiben. Ezek az eredmények a Current Alzheimer Research folyóiratban jelentek meg (2015, 12, pp814–828). A tanulmányban leírt gyógyszerszerű vegyületeket egy gyógyszercég, a Cantabio Pharmaceuticals licencelte és fejleszti tovább klinikai próbákra. Ezeket az eredményeket a The Scientist nemzetközi tudományos folyóirat 2017. októberi számában megjelent, Drugging the Disorderome című cikkben külön kiemelték.
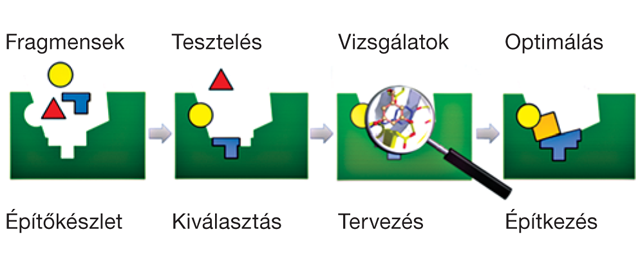
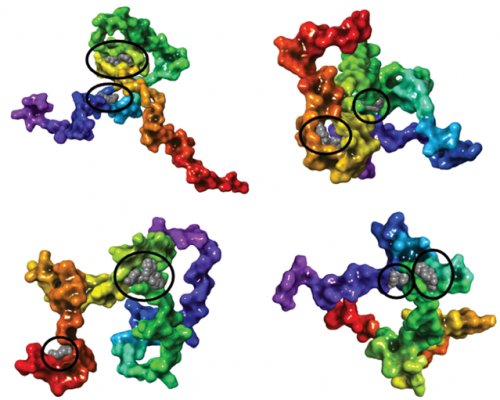 Gyógyszerszerű vegyületek megkötésére alkalmas kötőhelyek illusztrációja a tau heterogén szerkezeti konformációinak összességén. Fekete karikák emelik ki a lehetséges kötőhelyeket, melyekhez kismolekulák kötődnek.
Gyógyszerszerű vegyületek megkötésére alkalmas kötőhelyek illusztrációja a tau heterogén szerkezeti konformációinak összességén. Fekete karikák emelik ki a lehetséges kötőhelyeket, melyekhez kismolekulák kötődnek.A csoport továbbá tanulmányozza a PARK7 gén által kódolt, többféle enzimaktivitással rendelkező multifunkcionális DJ-1 fehérjét, amely részt vesz a sejten belüli redox- és fehérje-homeosztázis szabályozásában. A DJ-1 működésének elvesztése kapcsolatban van a PK és más neurodegeneratív betegségek kialakulásával és előrehaladásával. A csoport jelenleg a DJ-1 aggregációs folyamatait kutatja részletesebben, és ezek jelentőségét vizsgálja ezeknek a betegségeknek a kialakulásában. A Cantabio Pharmaceuticals céggel és a Cambridge-i Egyetem kutatóival együttműködve felfedezték, hogy a DJ-1 ß-redő szerkezetű fibrilláris fehérje aggregátumokba áll össze. Ez a folyamat részben felelős lehet a fehérje működésének elvesztéséért.
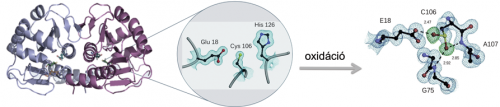 A DJ-1 fehérje egyik oxidált állapotának illusztrációja kóros körülmények között.
A DJ-1 fehérje egyik oxidált állapotának illusztrációja kóros körülmények között.A csoport tanulmányozza a DJ-1 chaperon működésének mechanizmusát is azzal a céllal, hogy a fehérje e funkciója játszhat-e védő és megelőző szerepet a PK kialakulásában. A DJ-1 gátolja ugyan az α-szinuklein aggregációját, azonban ennek a mechanizmusa még nem ismert. A csoport együttműködő partnerekkel kimutatta, hogy a DJ-1 fehérje oxidált állapotban erősen kölcsönhat a monomer α-szinuklein N-terminális részével, így az oxidált DJ-1 képes gátolni az α-szinuklein kezdeti aggregációs fázisát. Ebből adódóan a DJ-1 oxidációja kóros körülmények között a DJ-1 és az α-szinuklein kölcsönhatás által megelőzheti az α-szinuklein és a DJ-1 aggregációját, és ebből következően megvédheti az agysejteket az α-szinuklein által okozott toxicitástól. A csoport tanulmányozza a DJ-1 chaperon működését más releváns rendezetlen fehérjék aggregációjával kapcsolatban is, melyek szintén összefüggésbe hozhatók neurodegenerációs betegségek kialakulásával.•
2017. december